Die Nachfrage nach neuen Medikamenten gegen Adipositas wie Semaglutid (GLP-1-Rezeptor-Agonisten) ist groß, aber die Verfügbarkeit ist gering. Welche Patienten sollten sie also zuerst bekommen? Was sind die tatsächlichen Vorteile und Nebenwirkungen? Meine Patienten stellen mir diese Fragen relativ häufig, daher weiß ich, dass dieses Thema für Hausärzte wichtig ist. Ich habe deshalb die wichtigsten Studien durchgesehen und sie in diesem Artikel kurz und möglichst klar zusammengefasst.
1. Wie wirksam sind GLP-1-Rezeptor-Agonisten zur Gewichtsabnahme?
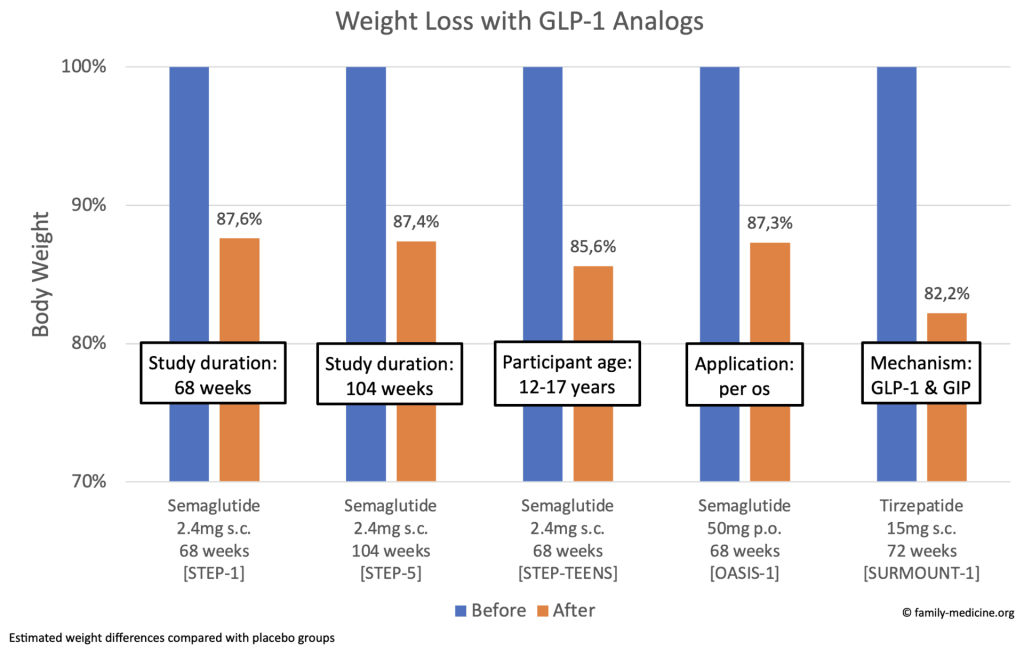
Wie man hier sehen kann, ist der Gewichtsverlust signifikant und nachhaltig. Semaglutid per os (50 mg) war ebenso wirksam wie die subkutane Anwendung (2,4 mg). Tirzepatid (15 mg) zeigte etwas stärkere Effekte als Semaglutid (2,4 mg).
Gibt es den sogenannten Rebound-Effekt wirklich?
Ja, ein Jahr nach dem Absetzen des Medikaments nehmen die Patienten ½ – ⅔ ihres Gewichtsverlusts wieder zu.

Was sind weitere klinische Vorteile?
Kardiovaskuläre Ereignisse
Die SELECT-Studie1 randomisierte 17.604 Patienten mit vorbestehender CVD und Übergewicht/Adipositas. Das relative Risiko für kardiovaskuläre Ereignisse wurde um 19% gesenkt (RRR), während das absolute Risiko über 40 Monate um 1,5% reduziert wurde (ARR). Mit anderen Worten: man muss 67 CVD-Patienten 40 Monate lang behandeln, um ein solches Ereignis zu vermeiden (bei CVD-Patienten: NNT=67 für 40 Monate).

Im März 2024 hat die FDA Semaglutid daher für die CVD-Sekundärprävention bei übergewichtigen oder adipösen Erwachsenen zugelassen.2
Herzinsuffizienz
Die STEP-HFpEF-Studie3 hat 529 Patienten mit Herzinsuffizienz (EF≥45%, BMI≥30) randomisiert und 52 Wochen lang mit s.c. Semaglutid 2,4 mg oder Placebo behandelt. Der klinische Nutzen bei Patienten mit Herzinsuffizienz erscheint sehr vielversprechend:

Die Verbesserungen der Herzinsuffizienz-Symptomatik korrelieren stark mit dem Ausmaß der Gewichtsreduktion: Diejenigen, die <5% ihres Gewichts verloren, verbesserten ihren KCCQ-CSS (Herzinsuffizienz-Score; 1-100) um nur 5 Punkte, während diejenigen, die 15%-20% abnahmen, sich um 20 Punkte verbesserten.4
Chronische Niereninsuffizienz
In der FLOW-Studie wurden 3.534 Patienten mit chronischer Niereninsuffizienz und Typ-2-Diabetes randomisiert und ab 2019 mit s.c. Semaglutid 1,0 mg oder Placebo behandelt. Die Studie wurde vorzeitig abgebrochen, da die Vorteile bis Oktober 2023 bereits deutlich sichtbar waren.5 Im März 2024 gab Novo Nordisk bekannt, dass in der Interventionsgruppe 24% weniger CKD-bedingte Ereignisse auftraten.6
2. Wie häufig sind Nebenwirkungen im Zusammenhang mit Semaglutid?
Therapieabbruch
Große Studien zeigen, dass etwa 4% der Patienten das Medikament (aufgrund von Nebenwirkungen, im Vergleich zu Placebo) nach 16-17 Monaten absetzen7,8 und etwa 8% brechen die Behandlung nach 34 Monaten ab1:

GI-Symptomatik
Übelkeit, Erbrechen, Durchfall, Verstopfung und Unterleibsschmerzen traten bei >10% der Patienten auf. Diese Symptome sind in der Regel mild oder moderat und kurz.9
Diabetische Retinopathie
Sie kann neu auftreten oder sich verschlechtern, wahrscheinlich aufgrund einer schnellen Verbesserung der Glukosespiegel:

Bei Patienten mit Diabetes ist es einer Frage von Herz-Nutzen vs. Augen-Schaden. Sowohl die FDA als auch die EMA empfehlen, dass Ärzte Patienten mit diabetischer Retinopathie, die mit Semaglutid behandelt werden, genau überwachen.10,9 Bei Patienten mit unkontrollierter oder potenziell instabiler diabetischer Retinopathie wird eine Behandlung mit Semaglutid 2,4 mg nicht empfohlen.9 Die American Academy of Ophthalmology bietet hier weitere Informationen11.
Pankreatitis
Die EMA hält Pankreatitis für selten (0,2% der Patienten),9 aber dennoch wurde in den Medien über diese Nebenwirkung berichtet, insbesondere aufgrund einer Studie12 die einen „neunfachen“ Anstieg vermuten ließ. Allerdings war diese Kohortenstudie klein, und die Schwankungsbreite der Ergebnisse war daher sehr groß und reichte von einem Anstieg um 25% bis zu 6.600% (!) (95% CI: 1,25 bis 66,00). Die Interpretation dieses Ergebnisses als „neunfacher“ Anstieg vernachlässigt diese Unsicherheit jedoch und ist daher nicht angemessen.
Schilddrüsenkrebs
Die FDA hat zwar eine Warnung für C-Zell-Tumoren der Schilddrüse und MEN-2 aufgenommen,10 die EMA kam im Oktober 2023 jedoch zu dem Schluss, „dass die verfügbare Evidenz keinen kausalen Zusammenhang“ zwischen GLP-1-Agonisten und Schilddrüsenkrebs zeigt.13 Hier Evidenz dazu: Zwischen 2004 und 2020 wurden der FDA 8.718 GLP-1-Analoga-assoziierte Tumore gemeldet.14 Während das Krebsrisiko insgesamt nicht erhöht war, wurden Schilddrüsen- und Pankreaskrebs 7- bzw. 10-mal häufiger gemeldet als bei anderen Medikamenten. Bedenke jedoch, dass zumindest ein Teil dieses Zusammenhangs durch eine verbesserte Melderate aufgrund früherer Warnungen erklärt werden könnte! Im März 2024 wurde dies durch eine große skandinavische Kohortenstudie unterstützt, die 145.410 Patienten über vier Jahre hinweg beobachtete und kein erhöhtes Risiko für Schilddrüsenkrebs feststellte.15 Auch eine systematische Übersichtsarbeit (2019) von 50.452 Diabetespatienten ergab keine statistisch signifikante Erhöhung des allgemeinen Krebsrisikos (OR 1,04; 95% CI: 0,94 bis 1,15).16
Suizidgedanken
Kürzlich wurden Suizidgedanken als eine mögliche Nebenwirkung von GLP-1-Rezeptor-Agonisten untersucht. Insgesamt erhielt die EMA 150 solcher Berichte, nach einer Exposition von über 20 Millionen Patientenjahren.17 Eine Analyse von 1,8 Millionen elektronischen Gesundheitsakten in den USA ergab ein geringeres Risiko für Selbstmordgedanken bei denjenigen, die Semaglutid einnahmen, als bei denjenigen, die andere Medikamente zur Gewichtsreduktion einnahmen.18 Während die EMA Suizid-Gedanken oder -Versuche nicht als Nebenwirkung aufführte,17 empfiehlt die FDA die Überwachung und das Absetzen von Semaglutid, wenn solche Symptome auftreten.10
3. Schlussfolgerungen
Was empfehlen Guidelines?
Aufgrund des weltweiten Mangels empfehlen viele Länder, keinen neuen Patienten Semaglutid zu verschreiben. Diese Empfehlung könnte sich jedoch bald ändern.
Die einzige Leitlinie, die ich bezüglich Semaglutid zur Gewichtsabnahme finden konnte, stammt vom NICE in Großbritannien (September 2023).19 Darin heißt es, dass nur neue Patienten, die die folgenden Kriterien erfüllen, Semaglutid erhalten können:
- Adipositas und mindestens eine gewichtsbedingte Komplikation (weitere Details in der Leitlinie)
- Patienten in einem multidisziplinären, spezialisierten Gewichtsmanagement-Programm
- Maximal 2 Jahre
- Behandlung beenden, wenn <5% Gewichtsverlust nach 6 Monaten.
Meine Gedanken
Die neuen GLP-1-Rezeptor-Agonisten zur Behandlung von Adipositas scheinen hochwirksam bei der Gewichtsabnahme, aber auch bei der Verringerung des kardiovaskulären Risikos und der Verbesserung der Symptome der Herzinsuffizienz zu sein. Die bisher identifizierten Nebenwirkungen sind zwar relevant, aber dennoch können viele Patienten von diesen neuen Medikamenten profitieren. Diese Fragen scheinen mir jedoch sehr wichtig zu sein:
- Wie priorisieren wir Patienten, wenn die Nachfrage hoch und die Verfügbarkeit gering ist? In einigen Ländern gilt das „first come, first served“ Prinzip: Diejenigen, die bereits GLP-1-Analoga einnehmen, sollen weitermachen, die anderen sollen warten. Aber würden nicht einige adipöse Patienten mit hohem kardiovaskulärem Risiko oder mit Herzinsuffizienz mehr profitieren?
- Was geschieht nach zwei Jahren der Behandlung? Machen wir weiter, ohne dass es Evidenz durch Langzeitstudien gibt, oder brechen wir ab, obwohl es Beweise für einen deutlichen Rebound-Effekt gibt?
- Sollte jeder, der davon profitieren könnte, ein Rezept erhalten? Jeder, der an Adipositas oder Herz-Kreislauf-Erkrankungen leidet (das sind mehr als 10% unserer Bevölkerung)? Sollten wir gleichzeitig weiterhin den Verkauf von Fast Food an Schulen zulassen? Es ist ein großer Fortschritt, wirksame Medikamente gegen Adipositas zur Verfügung zu haben, aber letztendlich behandeln wir die Symptome einer ungesunden Lebensmittelindustrie. Als Arzt und Wissenschaftlicher würde ich es begrüßen, wenn wir auch präventive Maßnahmen ergreifen, um das Problem an der Wurzel zu packen.
Zusammenfassung
- GLP-1-Rezeptor-Agonisten führen bei adipösen Erwachsenen und Jugendlichen zu einer deutlichen Gewichtsabnahme (etwa 13%-18%).
- Dieser Effekt hält (mindestens) zwei Jahre lang an, solange das Medikament weiterhin eingenommen wird (längere Studien sind noch nicht verfügbar).
- Das Absetzen des Medikaments führt zu einem Rebound-Effekt (½ – ⅔ Gewichtszunahme nach einem Jahr).
- Patienten mit CVD haben ein geringeres Risiko für kardiovaskuläre Ereignisse (19% relative Risikoreduktion, NNT von 67 über 40 Monate).
- Patienten mit Herzinsuffizienz weisen weniger Krankenhauseinweisungen auf und die Symptome verbessern sich (in Korrelation zu ihrem Gewichtsverlust).
- Bei Patienten mit Niereninsuffizienz treten weniger diesbezügliche Komplikationen auf (minus 24%).
- Leichte Nebenwirkungen sind häufig (vor allem gastrointestinal), schwere Nebenwirkungen sind wahrscheinlich selten.
- In naher Zukunft wird wohl auch eine orale Anwendungsform verfügbar sein.
Share this article:
- Klick, um auf Facebook zu teilen (Wird in neuem Fenster geöffnet) Facebook
- Klick, um auf LinkedIn zu teilen (Wird in neuem Fenster geöffnet) LinkedIn
- Klicken, um auf WhatsApp zu teilen (Wird in neuem Fenster geöffnet) WhatsApp
- Klicken, um einem Freund einen Link per E-Mail zu senden (Wird in neuem Fenster geöffnet) E-Mail
- Mehr






